PRUEBAS BIOQUÍMICAS BACILOS GRAM NEGATIVOS (09/01/18)
PRUEBAS BIOQUÍMICAS DE BACILOS GRAM NEGATIVOS
Dada la variedad de especies existentes, es preciso tener en cuenta el
origen de la muestra, la etiología posible y los medios de cultivo empleados en
su aislamiento.
En principio pueden distinguirse:
- Microorganismos que crecen en medios no enriquecidos y en medios propios para enterobacterias, que pueden pertenecer al grupo de las enterobacterias o al grupo de los no fermentadores de azúcares. Son bacterias que aíslan muy frecuentemente en laboratorios clínicos.
- Otras bacterias, que se aíslan sólo como resultado de una búsqueda específica, utilizando medios especiales; entre ellas podemos citar a Vibrio y Campylobacter, y por otra parte los microorganismos nutricionalmente exigentes como Haemophilus, Brucella, Bordetella y Legionella.
La identificación de bacilos G (-) puede iniciarse con la prueba de oxidasa
y la oxidación/fermentación de glucosa (O/F). El resultado de estas pruebas
permite iniciar la clasificación atendiendo al siguiente esquema:
OXIDASA
|
O/F
|
BACTERIA
|
+
|
+/-
|
Pseudomonas
|
+
|
+/-
|
Vibrio
|
-
|
+/+
|
Enterobacteriaceae
|
Para llevar a cabo dicha práctica, empleamos como bacteria: E. Coli
- MATERIAL
- Asas de siembra estériles
- Mechero Bunsen
- Placa de Petri cultivada con E. Coli
- Medio de Agar McConkey
- Tubos con diferentes medios, para la realización de las pruebas bioquímicas
El medio Agar hierro de KLIGLER (KIA) es un medio sólido diferencial, que se prepara en un tubo inclinado y que contiene lactosa (1,0%), glucosa (0,1%), peptona (20g) y un indicador de pH (rojo fenol) que vira a amarillo cuando el pH es ácido y que toma un color rojo más intenso (rojo cereza) cuando el pH es alcalino. También detecta la producción de sulfhídrico, ennegreciéndose el fondo del tubo.
La fermentación de los hidratos de carbono se produce tanto en condiciones anaerobias (fondo del tubo) como en condiciones aerobias (superficie inclinada), siguiendo varias rutas metabólicas.
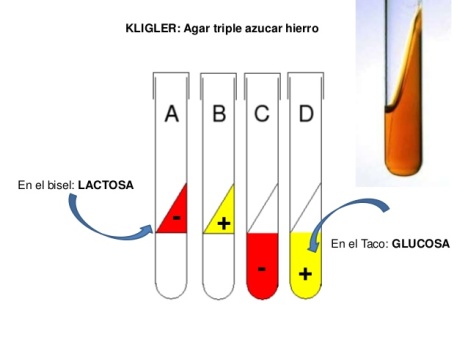
- PROCEDIMIENTO
- Se prepara el medio de Kligler, según las instrucciones del fabricante, se envasa en tubos, se esterilizan y se dejan solidificar en pico de flauta (poca inclinación).
- Se toma una colonia de la muestra y se siembra, con el hilo de platino, en picadura en el fondo del tubo y a continuación, se siembra en estría sobre la superficie del pico de flauta (también con el hilo de platino). Se incuban a 37ºC durante 24 horas.
https://youtu.be/2SK7PA7f9jc
- RESULTADOS
- Glucosa +
- Lactosa +
- Sulfhídrico -
2. IMVIC
Las pruebas IMVIC (INDOL, ROJO DE METILO, VOGES-PROSKAUER Y CITRATOS) son un conjunto de 4 pruebas diferentes. Se emplean fundamentalmente para la identificación de las Enterobacterias (bacilos Gram negativos, anaerobios facultativos con metabolismo
fermentador).
fermentador).
Producción de Indol
Se determina si la bacteria posee la enzima (triptofanasa). La triptofanasa hidroliza el triptófano en indol y alanina. El indol se detecta empleando un reactivo específico (Reactivo de Kovacs). El triptófano forma parte de las peptonas del medio.
- PROCEDIMIENTO
- Inocular el medio de cultivo (agua de peptona). Incubar a 37 ºC durante 48 horas.
- A las 24-48 horas, añadir unas gotas de reactivo de Kovacs. Agitar y dejar reposar el cultivo. El HCl proporciona el pH ácido que requiere la reacción. El alcohol amílico es, insoluble en agua y menos denso.
- RESULTADOS
El resultado es positivo, ya que después de añadir el reactivo de Kovacs, se ha producido un anillo rojo en la superficie.
Rojo de Metilo
- PROCEDIMIENTO
- Inocular el medio de Clark-Lubs. Incubar a 37ºC durante 48 horas.
- Añadir unas gotas de rojo de metilo (rojo a pH 4-5; amarillo a pH > 6)
En la imagen se observa un resultado positivo y negativo después de añadir el indicador (rojo metilo).
El resultado positivo es el tubo con el medio rojo.
Estudia la capacidad de las bacterias para metabolizar la glucosa por la vía de la fermentación butilen-glicólica (o butanodiólica), en la cual se forma acetoína (acetilmetilcarbinol), que es un producto intermediario en la producción de butanodiol. La acetoína puede ser detectada añadiendo al medio, alfa-naftol y KOH al 40% que reaccionarán con este compuesto produciendo un color rojo característico.
El medio de cultivo, es el mismo que en la prueba de rojo de metilo
- Inocular el medio de Clark-Lubs. Incubar a 37ºC durante 24- 48 horas
- Añadir unas gotas alfa-naftol (0.6 ml).
- Agitar y añadir KOH.
- Agitar y realizar una lectura a los 15 minutos.
- RESULTADOS
En nuestro caso el resultado negativo, ya que no observamos ninguna coloración roja
Consumo de Citrato
Se determina la utilización del citrato como única fuente de carbono y energía. Esta reacción es llevada a cabo por la enzima citrasa.
El test del citrato se lleva a cabo utilizando el medio "agar citrato de Simmons" que contiene:
- Citrato sódico como única fuente de carbono
- Ion amonio como única fuente de nitrógeno
- Azul de bromotimol como indicador de pH
El medio inicialmente es de color verde, pero cuando el microorganismo, que crece en este medio, utiliza el citrato, se forman productos alcalinos que hacen aumentar el pH del medio (> pH 7,6) causando el viraje del indicador azul (azul de bromotimol) contenido en el medio que pasa de verde a azul.
- PROCEDIMIENTO
Observar el procedimiento en el siguiente vídeo:
- RESULTADOS

Test de la Urea
acción del enzima ureasa (por ejemplo Proteus).
Este enzima al hidrolizar la urea (H2N-CO-NH2) origina amoniaco, el cual produce un
incremento del pH del medio que puede detectarse mediante un indicador (rojo fenol).
El test de la urea se realizar sobre un medio que lleva urea y un indicador de pH (rojo fenol), que por encima de pH 8,4 vira de amarillo a rosa. Se puede utilizar:
- Un medio sólido, en pico de flauta, contenido en un tubo, como puede ser el Agar urea de Christensen
- O un medio liquido como el Caldo urea indol (vamos a utilizar este)
- Las bacterias (se toma gran cantidad) se inoculan en el medio lÍquido
- Se incuba el tubo a 37ºC
- Se observa el viraje de color del medio a las 24 horas
https://youtu.be/cJavNQQDHMI
- RESULTADO
Tras incubar y echar al medio el reactivo de James, observamos que no se produce ningún cambio de color, por lo que el resultado es negativo (no se produce la hidrólisis de urea).
Para que el resultado fuera positivo, el medio debería haber virado a color rosa-fucsia
Fenilalanina desaminasa
El aminoácido fenilalanina, por desaminación oxidativa, se transforma en ácido fenilpirúvico (APP), que es un cetoácido que puede detectarse porque, al añadir cloruro férrico, forma un complejo de color verde. Solamente el género Proteus posee la fenilalanina desaminasa, lo que permite diferenciarlo del resto de las Enterobacterias. Por tanto, esta prueba se basa en la detección del ácido fenilpirúvico (APP).
El medio de cultivo, que contiene fenilalanina, no puede contener ni extractos decarne ni peptonas ya que tienen un contenido variable en fenilalanina.
- En el pico de flauta, del medio solido contenido en tubo, se siembra un cultivo puro de 24 horas y se incuba a 37°C durante 24 horas.
- Tras el período de incubación, se agregan 4 o 5 gotas de reactivo de cloruro férrico (TDA) al
10%, directamente sobre la superficie del agar.
- RESULTADOS
Tras incubar y añadir el TDA, observamos que no se produce ningún cambio de color en el medio, por lo que el resultado es negativo.
La prueba es positiva cuando aparece, de forma inmediata, un color verde intenso que indica la presencia de ácido fenilpirúvico (APP) (Proteus)
Observar este proceso en el siguiente vídeo:
https://youtu.be/T1k4A0CV2Ak





















Comentarios
Publicar un comentario